Получение суперсамцов (YY) Телапии

Нильская тиляпия Oreochromis niloticus (Linnaeus, 1758) является одним из наиболее значимых объектов рыбоводства (FAO, 2005; Nonglak et al., 2012). В коммерческом секторе нагул тиляпии до рыночного размера главная проблема. Рыба начинает размножаться в пруду, вызывая укрупнение популяции и повышая разброс особей по размеру и массе (Mair et al., 1997; Jiménez & Arredondo, 2000; Tariq-Ezaz et al., 2004). Кроме того, самки растут медленнее самцов и позже достигают рыночного размера. Однако рыбоводы, к моменту сбора, стремятся получить рыбу одного размера, поэтому уже на протяжении многих лет выращивание односамцовых популяций является эффективной и востребованной технологией (Vera-Cruz et al., 1996; Mair et al., 1997; Jiménez & Arredondo, 2000; Müller & Hörstgen, 2007). Чаще всего для смены пола используется гормональная обработка. Однако этот метод подвергается критике. Накопление гормонов в окружающей среде, и возрастание числа потребителей, которые не желают питаться обработанной рыбой (Piferrer, 2001; Müller & Hörstgen, 2007; Leet et al., 2011), заставляют искать альтернативные технологии трансформации пола. Одной из них является получение генетических самцов тиляпии (GMT) за счет скрещивания YY-самцов с XX-самками (Vera-Cruz et al., 1996; Mair et al., 1997).


О генотипе YY Существование самцов, гомозиготных по Y хромосоме, отмечено в 1958 году у медаки (Oryzias latipes). Японский исследователь Ямамото получил YY супер-самцов, используя гормоны и селективное скрещивание. Позднее, YY-особи были получены у гуппи (Poecilia reticulate, Yamamoto, 1963), золотой рыбки (Carassius auratus, Yamamoto, 1975) и тиляпии (Oreochromis niloticus и O.mossambicus, Varadaraj & Pandian, 1989). Опубликовано несколько работ с YY-самцами различных видов, хотя их выживаемость очень низкая. Например, супер-самцы вида Salmo gairdneri доживают только до стадии появления «глаза» в икринке (Johnstone et al., 1979).
Таким образом, возможность получить жизнеспособных самцов лосося с таким генотипом спорна (Calhoun & Shelton, 1983). В своей статье, Pandian и Sheela (1995) заключили, что наличие более одной Y-хромосомы в генотипе самца или самки снижает их жизнеспособность. Однако Mair с коллегами (1997) отмечал схожую с нормальными XY-самцами плодовитость и выживаемость супер-самцов нильской тиляпии (O. niloticus). Позднее, он продемонстрировал выгоду от выращивания в крупных масштабах односамцовых популяций.
Для изменения пола исследователь использовал генетические манипуляции. Именно он впервые описал пошаговое руководство получения YY-самцов нильской тиляпии. Технология Технология получения YY-самцов тиляпии включает серии этапов феминизации с изучением потомства на расщепление по половой принадлежности. Программа получения YY-мужские особей вида O. niloticus предложена на основе активного изучения генетики половой детерминации у тиляпий. Работа проходила в Университетском колледже Уэльса (Суонси, Великобритания). Её результаты показали, что представители данного вида имеют преимущественно монофакториальную генотипическую систему с гетерогаметностью самцов (XY) и гомогаметностью самок (XX) (Penman et al., 1987; Mair et al., 1990). Монофакториальный генотипический – находящийся под влиянием одного фактора — гена. Эта монофакториальная гипотеза, однако, не объясняет некоторые расхождения от прогнозируемого соотношения полов.
Возможно, это вызвано флуктуациями средовых факторов, например, температуры (Mair et al., 1990; Trombka & Avtalion, 1993). С другой стороны, влияние температуры на половую детерминацию не объясняет присутствие небольшого числа самцов в поколении предполагаемых самок, выращенных при нормальной температуре. Не исключено, что эти расхождения вызваны аутосомными или полифакториальными генетическими факторами.
Протокол Майера для получения супер-самцов тиляпии: 1. Феминизация потомства от скрещивания нормальных родителей (о гормонах написано ниже). На этапе феминизации пол мальков нельзя определить. Эта процедура успешно проводится с представителями вида O. niloticus и другими видами Oreochromis; 2. Определение трансформированных самок (XY) с помощью проверки её потомства. Так как морфологические, поведенческие особенности и особенности кариотипа этой самки не отличаются от её генетических сестер, остается лишь проверка по менделевскому расщеплению пола у следующего поколения. Для этого, самку скрещивают с нормальным самцом и наблюдают расщепление по полу 3:1 (1XX:2XY:1YY); 3. Скрещивают всех определенных в пункте 2 трансформированных самок (XY) с нормальными самцами (XY). В поколении у 25% особей получается интересный генотип – YY. От каждой самки (XY) получают потомство для дальнейшего исследования поколений; 4. Определение супер-самцов YY. Самцов (2XY и 1YY), полученных в пункте 2, скрещивают с нормальными самками (XX). Потомство от самцов (YY) будет состоять только из самцов. Хотя эта процедура позволяет определить особей с генотипом YY, она непрактична для крупного предприятия. Поэтому важно было, чтобы успешно завершились следующие этапы программы; 5. Проводится скрещивание самцов (YY) с ранее определенными самками (XY), полученными после обработки эстрогеном. Появляется поколение с двумя генотипами – XY и YY. Потомство делится на две группа, одна из которой подвергается феминизации; 6. Проводится проверка поколений для обработанных эстрогеном самок (XY и YY) и необработанных самцов (YY).
Предполагается, что в отсутствии различий трансформации XY и YY генотипов, 50% всех трансформированных самок будут иметь генотип YY. Проверка поколений при скрещивании самок с нормальными самцами (XY) должна показать, что от самок (XY) появляются мальки с генотипами (1XX 2XY 1YY), т.е. три самца на одну самку, а от самок (YY) – появляются практически только самцы. На практике, сложно провести статистическое отличие полового состава потомков от этих контрольных скрещиваний. Для облегчения задачи нормальные самки (XX) подвергаются маскулинизации андрогенами и превращаются в самцов (XX). Скрещивание этих самцов с самками XY и YY дает расщепление признака 1:1 и 1:0, соответственно; 7. Для выращивания самцов (YY) в большом количестве, без необходимости проведения проверки поколений, необходимо изучить потомство от скрещивания самцов (YY) с самками (YY);
8. Скрещивание самцов (YY) с самками (YY) приводит к появлению только самцов (YY). Для создания будущего маточного стада необходима феминизация потомства (YY). Методы феминизации Легче всего изменить пол рыбок с помощью орального введения эстрогенов и андрогенов. На этапе половой дифференцировки, в течение 14 (Srisakultiew, 1993) — 30 (Alvendia — Casauay and Carino, 1988) дней после вылупления, в корм малькам добавляются гормоны. Кормление осуществляется четыре раза в день. Протокол феминизации оптимизирован группой исследователей, Rosenstein с Hulata (1994) и Mair с Santiago (1994). Он предполагает в течение 20 дней кормить мальков сухим кормом, содержащим 1000 мг/кг диэтилстильбэстрола (DES). Сравнительно недавно была предложена феминизация выводка, состоящего из супер-самцов YY, под действием теплового шока. Выдерживание мальков (YY) в течение 21 дня при температуре 36ºC приводило к появлению 34% самок YY (32% после обработки DES) (Karayücel I. et al., 2003). Однако смертность была высокой (62.6% против 97%). Другие протоколы феминизации представлены в таблице (Abdel-Fattah M. El-Sayed. Tilapia Culture):
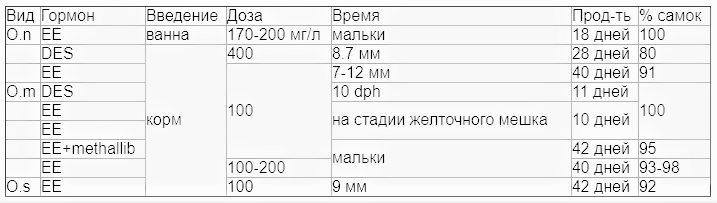
Виды: Oreochromis niloticus, O.mossambicus, O.spilurus. dph — дней после вылупления; EE — 17α-этинилэстрадиол; DES — диэтилстильбэстрола. Для маскулинизации (Guerrero III and Guerrero 1988 и Vera Cruz and Mair 1994) рыбок кормят в течение 25 дней рационом, содержащим 17α-метилтестостерона. Затем молодь пересаживается для подращивания в садки. Другие протоколы маскулинизации представлены в таблице (Abdel-Fattah M. El-Sayed. Tilapia Culture):
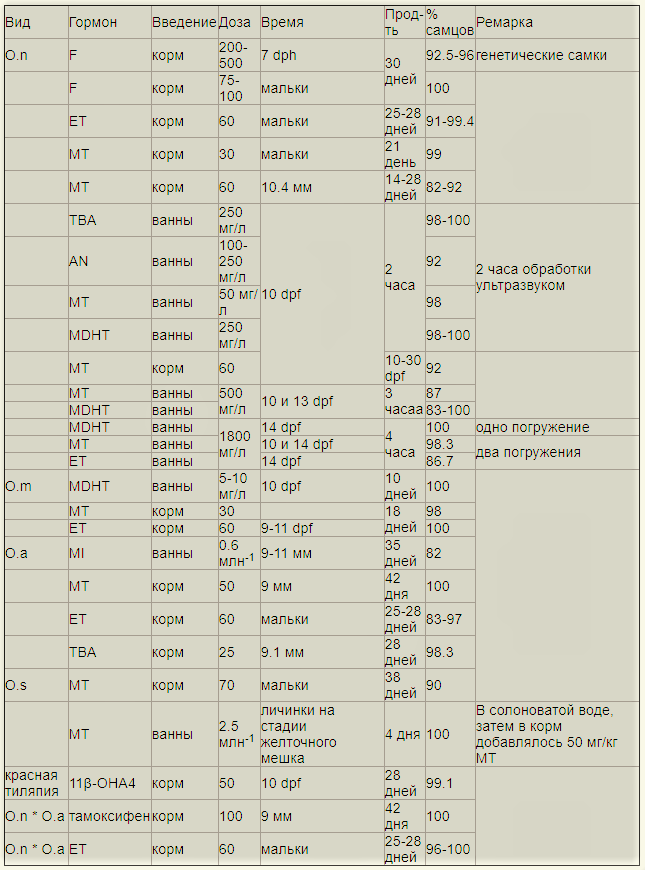
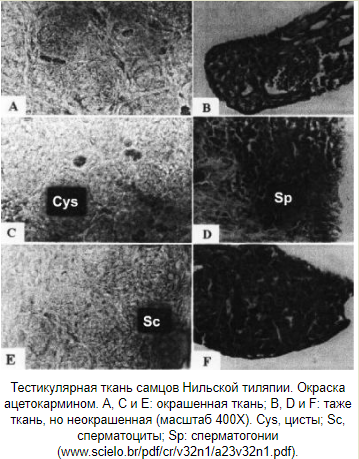
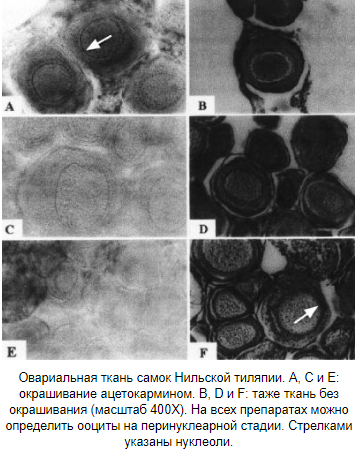
Виды: Oreochromis niloticus, O.mossambicus, O.aureus, O.spilurus. dpf — дней после оплодотворения; dph — дней после вылупления; F — фадразол; ET — 17α-этинилтестостерон; MT — 17α-метинилтестостерон; TBA — тренболон ацетат; AN — андростендион; MDHT — 17α-метилдегидротестостерон; MI — метилизотиазолинон; 11β-OHA4 — 11β-гидроксиандростенедион; тамоксифен Техника проведения проверки поколений Для проведения этого теста половозрелых тиляпий (150-200 дней) сажают на нерест в садки площадью 1 м2, погруженные в земляные пруды глубиной 60 см. Посадка осуществляется парами, либо по три самки на одного самца. Садки проверяются каждые 7 дней, икра и мальки собираются у инкубирующих самок. Затем самцы и самки родители маркируются пассивными интегрированными ретрансляторами (метки Passive Integrated Transponder) и помещаются в общий бетонный бассейн. Икринки и мальки инкубируются искусственно до момента, пока у них не рассосется желточный мешок. Затем они помещаются группами от одного родителя в садки с мелкой сеткой. Потомство выращивается примерно три месяца, пока они не достигнут массы 3 грамма. После этого их умерщвляют и по осмотру гонад определяют пол (техника размягчения Guerrero and Shelton, 1974. Описание метода — http://om.ciheam.org/om/pdf/b63/00800919.pdf http://www.scielo.br/pdf/cr/v32n1/a23v32n1.pdf ). В больших выводках необязательно умерщвлять всех особей. Достаточно взять наугад 100 особей, избегая предвзятости в выборе по размеру. На фотографиях снизу представлена ткань семенников и яичников мальков в возрасте 20-60 дней после вылупления. Масса рыбок 0.25-2.0 грамма, длина 26-53 мм. Половую принадлежность уже можно диагностировать.
Особенности половой системы супер-самцов (YY) Специалисты из Филиппин провели сравнение развития половой системы самцов тиляпий, имеющих нормальный гетерозиготный генотип (XY) и гомозитный (YY). В работе использовались нильские тиляпии вариации Египет-Суонси, полученные в программе «Исследования генетики рыб». Особи выращивалась в Центре Пресноводной аквакультуры государственного университета Центрального Лусона (провинция Нуэва-Эсиха, Филиппины). Анализ тканей проводился в Исследовательском институте естественных наук, Университет Филиппинс, (город Кесон-Сити, Филиппины). В ходе развития примордиальные (зачаточные) герминальные клетки развивались у обоих типов самцов в одно время, т.е. к 8 дню после вылупления. Эти клетки были крупнее у YY-особей (1.85 против 0.9 мк) и к 9-22 дню закладывали зачатки гонад. У YY-самцов раньше формировались семенниковые доли, к 15 дню. Росток (бластема) половых путей появлялся у YY-особей к 23 дню, а у XY-особей к 27 дню. К 79 дню у обеих групп отмечалось множество делящихся мейозом клеток. К 95 дню полностью дифференцированные семенники YY-самцов содержали зрелые сперматозоиды, тогда как у XY-самцов созревание длилось 105 дней. Супер-самцы имели более крупные семенники, с более толстой соматической тканью, больше сперматогенных клеток, и их половая система развивалась раньше. Размер герминальных клеток и размер их ядра не отличались у обоих типов самцов.
Источник aquavitro.org